Twitter@YaUsGfcqxuo2ffx)です

けんぼう先生
今日は中学校理科質量について学んでいくよ

未来けんぼう
質量?

けんぼう先生
化学変化での重さに注目していくよ

未来けんぼう
イエス!
化学変化と質量の関係
前回の記事はこちら
これだけ覚えて点数アップ!中学2年理科還元と化学反応式テスト対策問題
質量に関する問題はテストでも必ずと言っていいほど出題されるて
必要な言葉や記号を暗記してテスト対策していこう
ここでは実験前と後の質量の関係を説明でき計算できるようになればOKだよ
質量保存の法則
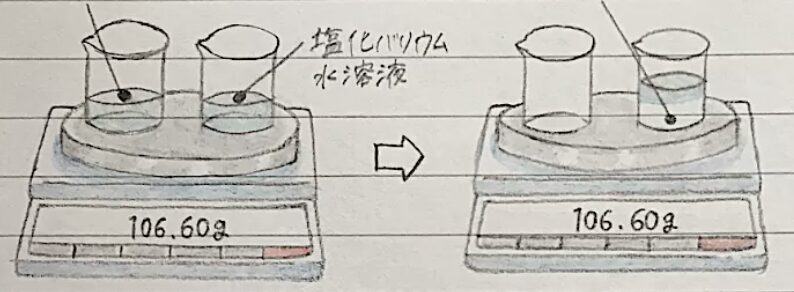
- 硫酸から見る質量
- うすい硫酸とうすい水酸化バリウム水溶液を別々の容器に入れ、質量をはかる
この2つの水溶液を混ぜるとどうなる?
→白色の硫酸バリウムの沈殿ができる - このときに混ぜる前と混ぜた後の質量を測ってみると
→どちらも質量は変わらない
- うすい硫酸とうすい水酸化バリウム水溶液を別々の容器に入れ、質量をはかる
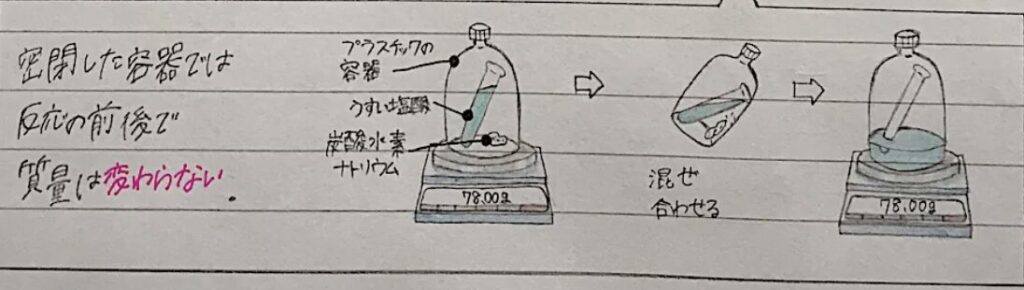
- うすい塩酸と炭酸水素ナトリウムから見る質量
- うすい塩酸と炭酸水素ナトリウムを混ぜる
必ずふたをしておく
→二酸化炭素という気体が発生するよ
この時の質量を測るとどうなるか
=混ぜる前と混ぜた後でも質量は変わらないよ
ふたをあけてしまうと二酸化炭素が空気中に出てしまって期待がでたぶんその分軽くなるからね
- うすい塩酸と炭酸水素ナトリウムを混ぜる
- 質量保存の法則
- 2つの実験から分かることは混ぜる前と混ぜた後も質量に変化がなかったよね
このことを質量保存の法則というので絶対に覚えておこう
→ポイントは原子の数が変わらないと質量保存の法則が成立するということ
=化学変化の前後では原子の組み合わせは変わるが原子の種類と数は変わらない。
=化学変化だけでなく状態変化など、物質の変化すべてになり立つよ
状態変化は固体が液体などになることだね
例えば氷を水にしても体積や密度は変わっても質量は変わらないということだね
- 2つの実験から分かることは混ぜる前と混ぜた後も質量に変化がなかったよね
化学変化と物質の質量比
- 金属と化合する酸素の質量
→一定量の銅を加熱したときの加熱後の質量の変化を実験で見ていこう
【実験】
①ステンレス皿の重さをはかっておく
②2.0gの銅を加熱→酸化銅がてきる
③②から①をひいて、加熱後の重さをまめる
②~③の操作をくり返す
【結果】
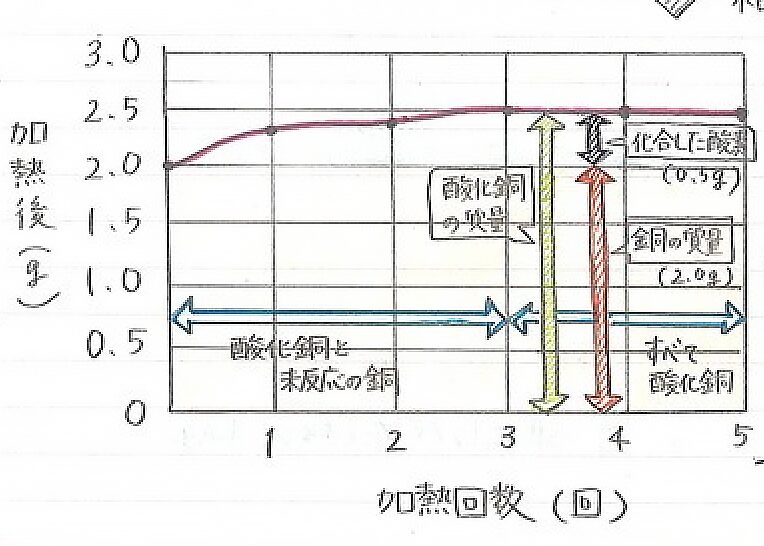
イラストのように一定量の金属と化合する酸素の質量には限度があり、その限度は、金属の種類によってちかうということが分かるよね。
化合する酸素の質量はだんだん減っていく
1回目よりも2回目は減っているよね
この理由は化合してない銅が減ったからなんだよ
3回目で全ての銅が反応したのが分かるね
3回目からグラフが横ばいで変わってないよね
- それぞれの質量の比
→まずはそれぞれの物質の比率を頭に入れよう
ここを覚えなければ計算ができないので何もわからなくてもまずは覚える!!- 銅と酸素の質量の比率
銅+酸素→酸化銅
=銅4:酸素1:酸化銅5
銅が4:酸素が1と覚えておこう - マグネシウムと酸素の質量の比率
マグネシウム+酸素↑酸化マグネシウム
=マグネシウム3;酸素2:酸化マグネシウム5
マグネシウムが3:酸素が2と覚えておこう
どの比率も酸素の方が小さいのでどっちがどっちの比率かわからなくなったら
小さい方の比率が酸素と覚えておこう
- 銅と酸素の質量の比率
物質の質量比計算方法
- 核物質の計算問題
→では実際に計算して解いていこう
この分野はテストで絶対に出されるのでしっかりと理解しておこう- 6gの銅が完全に酸化する時化合する酸素の質量は?
銅と酸素の話なので
→銅4:酸素1を使うよ
=銅4:酸素1=銅:酸素
銅は6gとわかっているよね、わからないのは酸素なので酸素をXとおこう
4:1=6:X
4X=6
X=1.5
よって完全に酸化するのは酸素の質量が1.5g - 9.0gの酸化銅をつくるために必要な銅の質量は?
酸化銅と銅の話なので
=銅4:酸素1:酸化銅5を使うよ
銅はわからないので銅をXとするよ
4:5=x:9
5x=36
x=7.2g
よって必要な銅の質量は7.2g - 2.5gの銅を加熱したときに加熱後の質量は2.9gだった
酸素と化合してない銅の質量は?
今回は酸素と化合してない銅の質量を求めたいので
いきなり比の計算はできないので
2.9-2.5をして0.4という酸素の量を出す必要がある
元々2.5gの銅に酸素がくっついて2.9gになったので
酸素の元々の量が0.4というのを出す必要があるよね
銅と酸素の話なので
=銅4:酸素1を使うよ
わからないのは銅なので銅をX
4:1=X:0.4
これを解くとX=1.6gになるね
最後に2.5-1.6=0.9gが答えだよ
- 6gの銅が完全に酸化する時化合する酸素の質量は?

ポイントは何と何の話で比率を使うか考えるだね
中学理科定期テストレベルテスト対策問題

銅を加熱して酸化銅を生成する実験を行った。
次の各問いに答えなさい。
- 実験の結果から、銅の質量と、化合する酸素の質量の比を簡単な整数比で書きなさい。
酸化銀→銀+酸素
↓解答解説↓
答え→4:1 - 銅4.4gをすべて酸化させたときにできる酸化銅の質量は何か
↓解答解説↓
答え→5.5g
Cu:CuO=Cu:CuO
4:5=4.4:X
4X=22
X=5.5g - 酸化銅 6.5gに含まれる銅は何gか
↓解答解説↓
答え→5.2g
Cu:CuO=Cu:CuO
4:5=X:6.5
5X=26
X=5.2g - 銅1.6gを加熱したところ、加熱が不十分だったため、銅の一部が残って、加熱後の物質の質量は1.8gになった。
このとき、酸素と化合してない銅は何gか
↓解答解説↓
答え→0.8g
Cu→1,6g
(酸素0.2g)
Cu+CuO→1.8g
よって
Cu:O=Cu:O
4:1=X:0.2
X=0.8g
これは酸素と化合した銅なので
反応してない銅は1.6gー0.8g=0.8g

銅をマグネシウムに変えて同様の実験を行った
次の問題に答えよう
- マグネシウム3.6gをすべて酸化させたときにできる酸化マグネシウムは何gか
↓解答解説↓
答え→6.0g
Mg:MgO=Mg:MgO
3:5=3.6:X
3X=18
X=6.0g - マグネシウム 2.4gをすべて酸化させて、酸化マグネシウム 4.0gができた。
化合した酸素は何gか。
↓解答解説↓
答え→1.6g
MgO-Mg=O
4ー2.4=1.6 - 酸化マグネシウム 7.5gに含まれる酸素は何gか
↓解答解説↓
答え→3.0g
MgO:O=MgO:O
5:2=7.5:X
5X=15
X=3g - 硫化鉄 27.5gに含まれる鉄は何gか
↓解答解説↓
答え→17.5g
FeS:Fe=FeS:Fe
11:7=27.5:X
11X=192.5
X=17.5g - 鉄5.6gと硫黄2.8gをよく混ぜ合わせて加熱すると、完全には反応せずに一方の物質が残った。
反応しないで残った物質の原子の記号とその残った物質の質量は何gか。
↓解答解説↓
答え→Fe、0.7g
Fe:S=Fe:S
7:4=X:2.8
4X=19.6
X=4.9g(硫黄2.8gと反応する鉄の質量)
鉄は5.6gあるので
5.6gー4.9g=0.7g
よって鉄gは0.7g残る
質量保存の法則と物質割合のまとめ
記事のまとめ
- それぞれの比率の式を覚えておこう
- 計算するときには何の式を使うかを確認する
- 化学反応式まで覚えておこう
- テストでよく出る範囲なのでおぼえておこう
次は科学変化と熱の関係性について見ていこう
これだけ覚えて点数アップ!中学2年理科7化学変化と熱の関係テスト対策問題
リンク